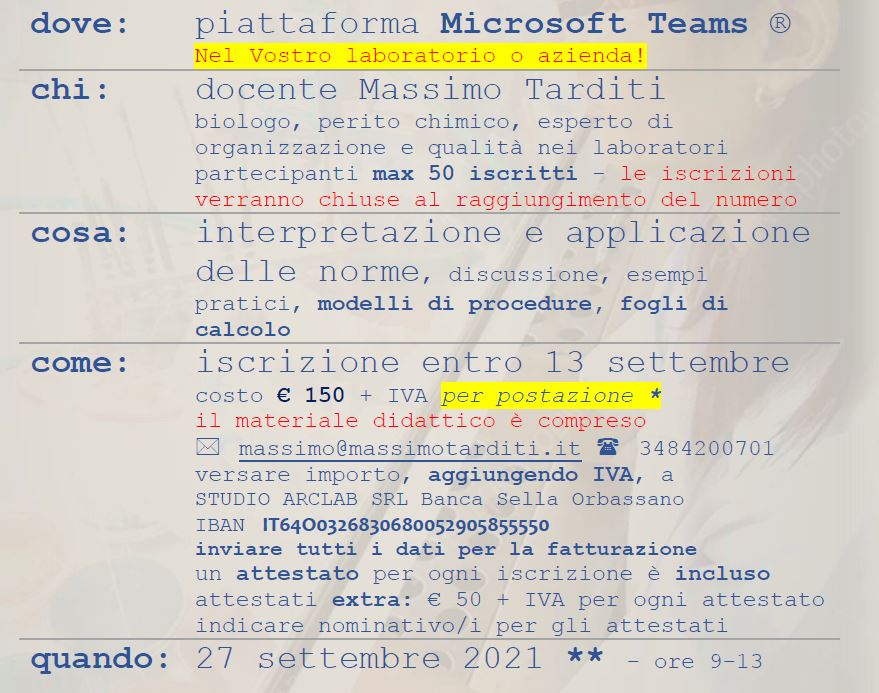
Corso “Validazione e verifica prestazionale nel laboratorio microbiologico”
LA VALIDAZIONE E VERIFICA PRESTAZIONALE DEI METODI NEL LABORATORIO CHIMICO E MICROBIOLOGICO
Si devono “validare” tutti i metodi?
Ha un senso l’approccio “chimico” (scarto tipo di ripetibilità, ecc.) alla verifica di prestazione dei metodi microbiologici?
È proprio necessario ripetere ogni anno le prove prestazionali?
Si devono eseguire prove su campioni positivi e negativi, per le analisi qualitative?
Conoscete già la nuova norma ISO 16140-3:2021? (e magari anche la ISO 13843:2017…)
Il corso fornisce queste ed altre risposte approfondendo tutti gli aspetti relativi alla messa a punto dei metodi in microbiologia: corretta interpretazione dei requisiti normativi, impostazione ed esecuzione delle attività, utilizzo dei dati, costruzione di un unico processo che consenta di gestire col minimo impegno di risorse il monitoraggio delle competenze, la garanzia di qualità del dato, la stima dell’incertezza, la valutazione iniziale e il monitoraggio nel tempo delle prestazioni dei metodi.
Verranno fornite le indicazioni pratiche per arrivare a questo risultato, ottimizzando la gestione delle risorse e riducendo al minimo il tempo e il consumo di materiali, verranno forniti fogli di calcolo per l’elaborazione dei dati, gli esempi di esempi di procedura e di testo del manuale qualità, in formato word.
CONTATTACI
Scrivi un’email per avere informazioni sul corso e per iscriverti
RICHIEDI INFORMAZIONI
Le domande formulate dai partecipanti durante il corso

…e relative risposte



Buongiorno. Innanzi tutto grazie per aver illustrato in maniera chiara e semplice le novità della 16140-3. Un mio primo dubbio riguarda i tempi che il laboratorio si deve dare per sottoporre a verifica prestazionale le prove che ha già accreditato. Posto che non si può bloccare l’attività di laboratorio per eseguire in pochi mesi le millemila prove richieste per ogni parametro, può essere corretto prendere come riferimento le date indicate dalla nota “transition period for the implementation of ISO 16140-3”, in cui si indica il 31/12/2027 come endpoint per i metodi non validati?A quello che ho capito, si dà tempo alle commissioni ISO e CEN di validare tutti i metodi. In questo caso, il laboratorio potrebbe iniziare dai metodi che ad oggi indicano i dati di validazione per poi aspettare gli aggiornamenti degli altri (oppure ci possiamo dare altri criteri di priorità). Grazie
Grazie Tiziana per la richiesta, in effetti non ho approfondito nel corso questo specifico punto.
Qui c’è la nota a cui fai riferimento:
https://committee.iso.org/files/live/sites/tc34sc9/files/Method%20validation-verification/Transition_period_for_the_implementation_of_ISO_16140-3_version_20210119.pdf
Dalla nota emerge che, fino a tutto il 2027, PER I METODI DI RIFERIMENTO PRIVI DI DATI DI VALIDAZIONE, come specificato in ISO 16140-3, il laboratorio può fare riferimento all’allegato F della norma, può cioè evitare la verifica di implementazione.
Successivamente non potranno più essere utilizzati metodi di riferimento privi dei dati suddetti, senza che il laboratorio provveda esso stesso alla validazione.
Per quanto riguarda invece l’applicazione della ISO 16140-3 per i metodi GIA’ ACCREDITATI, come del resto ho accennato nel corso (“chi ha avuto ha avuto avuto…”, ecc.), non è richiesto ai laboratori di provvedere a una nuova verifica. Resta da vedere come i laboratori dovranno provvedere alla “verifica di mantenimento delle prestazioni nel tempo”, richiesta da Accredia in RT 08. Questo ce lo dovrebbe dire Accredia.
Invece, per i metodi che saranno revisionati successivamente all’accreditamento, il laboratorio dovrà procedere a valutare l’impatto delle modifiche e procedere di conseguenza (riverificare, integrare, ecc.).
Grazie. Staremo ad aspettare nuovi chiarimenti
Buon pomeriggio,
Il lavoro che abbiamo in programma per la prossima visita ispettiva Accredia di febbraio 2022 è l’accreditamento dello strumento TEMPO Biomerieux per analisi quantitative (carica batterica, coliformi, Escherichia coli, enterobatteri) su alimenti.
Noi siamo già da molti anni accreditati per tutte queste analisi con i metodi ufficiali ISO, ma è sempre maggiore la necessità di ridurre le tempistiche d’analisi e velocizzare i processi.
Devo pertanto fare la verifica dei metodi, quindi dimostrare di saperli utilizzare perché sono già stati validati.
Quindi uso la ISO 16140-3 a tale scopo, è corretto?
Lo specialist dello strumento mi consiglia l’uso del ceppo di Escherichia coli ATCC 25922 per tutti i parametri, per contaminare gli alimenti.
Credo che il mio problema ora sia capire quali e quanti alimenti testare, visto che per la ISO 19036 abbiamo già fatto una suddivisione in alimenti monoingrediente/multingrediente (vista con visita ispettiva 2021).
Spero di essere stata abbastanza chiara nella spiegazione.
Cordiali saluti
Dott.ssa Ilenia Zangrossi
Responsabile Microbiologia
buongiorno dottoressa
E’ corretto utilizzare la norma, effettuando le verifiche di implementazione e “per matrice”, sul numero di categorie di prodotti indicato dalla norma stessa (esempio 1+5 in caso di applicabilità del metodo ad “alimenti” in genere). In linea di principio, essendo il ceppo riferibile a tutti i parametri determinati, può essere sufficiente utilizzarlo per tutti gli studi. Sicuramente le categorie da voi scelte (monoingrediente/multingrediente) non corrispondono a quelle indicate nell’appendice A della norma, dovreste quindi rivedere la classificazione.
BuongiornoDott.Tarditi
Con che criterioposso scegliere, per la verifica di un metodo normato, il protocollo 1 o il protocollo 3?
Mi spiegomeglio.
Per la relativa semplicità, io opteri per il protocollo 3 (1 concentrazione del micorganismoper 7 repliche) che però non fornisce il eLOD.
Pertanto nel caso di metodi qualitativi che utilizziamo per ottemperare il Reg2073, posso ugualmente utilizzare il protocollo 3 anche se l’espressione del risultato dovrebbe essere non rilevabile o rilevato? Oppure in questo caso DEVO necessariamenteutilizzare il protocollo 1?
Di conseguenzail protocollo 3 posso utilizzarlo solo per i metodi qualitativiin cuiposso esprime il risultato come presenza/assenza?
Buongiorno dottoressa, il protocollo 3 si può utilizzare – in linea di massima – quando non è noto con sufficiente precisione il livello di contaminazione dell’inoculo (a meno di voler allestire una serie molto estesa di diluizioni successive ternarie, da ciascuna delle quali inoculare sette sospensioni iniziali, determinando in parallelo l’effettivo livello di contaminazione dell’inoculo). Tutto il discorso del LOD 50 è comunque riferito soltanto alle determinazioni qualitative (presenza/assenza). L’espressione del risultato secondo il Reg. 2013 del 2005 è un’altra vexata quaestio che molto appassiona (come molti altri aspetti meramente formali e “burocratici”) certi “addetti ai lavori”. Ritengo corretto esprimere il risultato come “non rilevato in X g, limite di rilevabilità Y ufc/g” o come “presente in X g”, ma credo che “presente” e “assente” siano molto più comprensibili agli interlocutori del laboratorio.
So che è passato tempo dal corso e mi scuso per la domanda , ma ho bisogno di avere la conferma che quando si parla di ISO validate si intendono esclusivamente quelle in cui sono dichiarate le caratteristiche prestazionali del metodo stesso.
Aggiungo che mi occupo quasi esclusivamente di acque ( più o meno potabili)e quindi da tempo stavo applicando la 13843 del 2017.
Ogni volta che la rileggo mi vengono continui dubbi.
Uno di questi è : cosa e come verificare nel tempo le prestazioni del metodo e degli operatori.
La ringrazio per il tempo che potrà dedicarmi.
buonasera dottoressa, nessun problema, il forum è sempre aperto
le norme validate sono quelle che forniscono i dati di validazione
non vi sono indicazioni precise, al momento, su come controllare il mantenimento delle prestazioni nel tempo, in microbiologia
…speriamo che nei prossimi incontri Accredia laboratori sappiano dirci qualcosa di appropriato e preciso
Buongiorno, qual’è il tempo massimo di messa in pratica delle modifiche pubblicate in una nuova ISO di un metodo?
nello specifico: ho un metodo già accreditato, esce una nuova versione del metodo (che sostituisce la precedente),
recepisco la nuova versione sapendo che c’è, ma quanto tempo massimo ho per mettere in uso nel mio laboratorio il metodo con le modifiche? un anno?
in quale documento si può trovare questa indicazione?
grazie mille
Stefania
Buongiorno, secondo il documento Accredia RT 08 il laboratorio ha tempo tre mesi per il recepimento dei nuovi documenti prescrittivi applicabili. Ciò significa che entro tre mesi dalla pubblicazione, salvo specifiche diverse indicazioni (per esempio per il recepimento della ISO 17025 ultima edizione sono stati concessi anni per la transizione), il laboratorio deve operare secondo le indicazioni del nuovo documento.
Buongiorno, grazie della risposta, quindi capisco che nel caso specifico della modifica al metodo per la conta di Stafilococcus aureus e per mantenere l’accreditamento del metodo stesso
abbiamo 3 mesi per implementare e mettere a routine quanto scritto nel nuovo metodo ISO. Corretto?
è questo il caso applicativo per una VERIFICA del metodo stesso?
(le modifiche non sono a mio parere irrilevanti rispetto a a quanto già facciamo)
grazie nuovamente della disponibilità
Buongiorno, esattamente, in generale. Il caso dei metodi ISO 6888-x:2021 è però particolare per quanto riguarda l’aspetto relativo alla ISO 16140-3:2021: i dati di validazione RESTANO quelli precedenti, quindi, ragionevolmente, non si dovrebbe provvedere all’aggiornamento della verifica prestazionale, in base a quanto indicato nel documento ISO sul passaggio alla ISO 16140-3. Dovrebbe essere sufficiente formalizzare la valutazione della NON necessità di adeguamento, ad esempio nel riesame di direzione o in un documento di registrazione del piano di cambiamento.
direi che siamo allineati con quanto pensavamo.
grazie mille della disponibilità, buon lavoro
Buongiorno Dott. Tarditi,
continua a non essermi chiaro come gestire l’annosa questione della ripetibilità in un laboratorio microbiologico alimentare. Gli ispettori immagino continueranno a chiederla e dovendo verificare nuovi metodi, che attireranno l’attenzione degli ispettori.. nasce spontanea la domanda.
La ripetibilità viene usata per il mantenimento e la verifica degli operatori. Quando si è in tanti tecnici basarsi solo sulle prove interlaboratorio non basta, per cui come possiamo verificare gli operatori senza la ripetibilità del metodo? Vero che la competenza di un operatore non scade, ma avendo date di verifica prestabilite come possiamo approcciarci senza la ripetibilità?
Buongiorno dottoressa, nel corso dei recenti incontri Accredia/ispettori/laboratori, a precisa domanda (mia), è stato risposto dal vice direttore di dipartimento che “per ora non andremo dai laboratori a chiedere l’adeguamento alla ISO 16140-3” (peraltro ho notizia da più fonti ed esperienza diretta che dimostrano il contrario: ispettori che fanno rilievi sul mancato adeguamento alla ISO 16140-3 ce ne sono). La mia domanda riguardava anche lo status della ripetibilità in microbiologia: a questa parte della domanda la risposta è stata “ma la ripetibilità può essere utilizzata anche per il mantenimento della qualifica, per l’assicurazione qualità e per la verifica da parte di Accredia”. Risposta che trovo insoddisfacente e vaga. “Può” non vuol dire deve e, soprattuttto, nessun documento attualmente applicabile prescrive ai laboratori SPECIFICAMENTE la verifica di ripetibilità (nemmeno l’RT08 rev. 4, punto 7.2.1.5, vedremo cosa scriveranno nella imminente rev. 5; nel punto 7.6.3 è richiesto di confrontare il limite di ripetibilità, del metodo o calcolato dal laboratorio, con l’incertezza, ma questo confronto non ha alcun senso in microbiologia essendo diversi i procedimenti e gli approcci per le due stime, e non essendo soddisfatta la condizione nemmeno dai dati pubblicati nei metodi normalizzati). Il monitoraggio delle competenze, come ho spiegato ampiamente nel corso aulla qualità in microbiologia (metodo “della bicicletta”), non necessariamente si basa sulla verifica di ripetibilità (altro approccio privo di senso, data la variabilità intrinseca dell’analisi microbiologica).
POSSO UTILIZZARE CEPPI SCADUTI?
SE SI FINO A QUANDO?
E QUALI SONO LE PROVE ED I CRITERI DA ADOTTARE?
Buongiorno dottoressa,
I ceppi con data di validità dichiarata dal produttore (non si tratta di una vera e propria “scadenza”) oltrepassata possono essere utilizzati a determinate condizioni. La data indicata è quella fino alla quale il produttore garantisce la validità, nelle condizioni di conservazione previste. Non c’è un limite ulteriore, purché i ceppi mantengano le proprie caratteristiche e prestazioni. Alcuni microrganismi sono più stabili, altri meno, occorre sempre fare un ragionamento caso per caso. I criteri e modalità per valutare i ceppi sono quelli indicati al secondo capoverso del paragrafo 5.4.2.1 dell’attuale iSO 11133 e nel successivo paragrafo 5.4.2.2. Seppur non siano indicazioni dettagliatissime, si può dedurre che è possibile ad esempio valutare le caratteristiche di crescita (intensità, ecc.) e quelle morfologiche e biochimiche. Ovviamente, visti i prezzi attuali dei ceppi, bisogna chiedersi se il gioco vale la candela. Forse meglio togliersi il pensiero e comprare ceppi “freschi”.
Buona sera Dott. Tarditi, ho appena finito di visionare la registrazione del corso e vorrei condividere con Lei alcuni dubbi.
1) Sulla base della classificazione dei campioni secondo la ISO 16140-3 a mio avviso i “tamponi da carcassa” sono da inquadrare nella categoria Alimenti “carne cruda”, tipo “carni fresche” e non nella ” Categoria “Campioni ambientali” pertanto non è necessario effettuare una sperimentazione ad hoc prevista invece per le “altre categorie”. Ma se il tampone da carcassa è assimilabile ad un Alimento non mi spiego la necessità nella denominazione della prova accreditata di inserire il riferimento alla ISO 19704 (con esclusione del campionamento ove non eseguito) + la ISO specifica. Lei che ne pensa?
2) Una domanda su un caso pratico: Conta del Campylobacter con metodo ISO con campo di applicazione molto ampio ma con validazione effettuata solo su 4 categorie di alimenti e su 1 altra categoria (produzione primaria). Stando così le cose il campo di applicazione della validazione si deve considerare limitato alle sole matrici utilizzate nel circuito interlaboratorio e pertanto non può essere esteso a tutti gli alimenti? Visto che i parametri prestazionali sono stati determinati solo analizzando alcune matrici alimentari (<5) per la verifica è necessario seguire l'allegato F (cioè quello per metodi non del tutto validati) oppure è sostenibile effettuare la verifica dell'implementazione scegliendo una delle 4 categorie alimentari oggetto della validazione?
3) Un ultimo aspetto relativo alla stima dell'e-bias. La valutazione dei tre livelli deve essere effettuata in un'unica sessione o può essere fatta in tempi diversi? Infine è possibile stimare l'e-bias facendo esguire la prova a più operatori per es. 1 livello/operatore oppure 1 replica/operatore di uno stesso livello?
La ringrazio
Buonasera dottoressa, ecco le risposte:
1) Nella ISO 16140-3 non ci sono riferimenti specifici ai “tamponi” su carcasse ma troviamo, nella tabella A.1, la matrice “carcasse” tra quelle della categoria “carni crude”. Nessun riferimento a matrici riconducibili a “carcasse”, invece, per quanto riguarda i campioni da produzione primaria, alla fine della stessa tabella. La ISO 17604 (non la ISO 19704, immagino si tratti di un refuso) riguarda il “campionamento” su carcasse e comprende anche metodi distruttivi. Direi quindi che senza dubbio, secondo logica, la matrice sia inquadrabile nella categoria “carni”. Riguardo alla denominazione del metodo, invece, non mi pronuncio: la logica rimane solitamente fuori dall’uscio quando ci si avvicina ai misteri della DA online e a quanto ad essa gira attorno e di solito tre funzionari forniscono da quattro diverse indicazioni in su sul come procedere.
2) I metodi con dati di validazione pubblicati relativi a meno di quattro categorie di alimenti sono considerati dalla ISO 16140-3 come riferiti “a una gamma limitata di alimenti” (alla lettera). Non serve in questi casi verificare altre categorie. Resta però il fatto che il metodo è dichiarato applicabile “ad alimenti in genere”, quindi il laboratorio potrà applicarlo a qualunque alimento. Non si applica l’appendice F, che è riferita a metodi “senza alcun dato di validazione pubblicato” (in questo caso siamo in una situazione intermedia). La verifica “per matrice” si eseguirà sulle categorie indicate nei dati di validazione. Ho messo una tabella riassuntiva nei materiali del corso, su questo punto.
3) Nulla vieta di effettuare le verifiche ai diversi livelli nel corso di esperimenti diversi, anche se svolti da operatori diversi, anche per le due repliche. Non è richiesto di operare in condizioni di ripetibilità (anzi, farlo sarebbe un ottimo modo per prendere un piccione in più con la stessa fava…).
Buongiorno Dott. Tarditi,
durante l’ispezione Accredia ci hanno chiesto di verificare che l’incertezza di misura del laboratorio (SIR) sia congruente con quella del metodo di prova (R), nel dettaglio conta stafilococchi coagulasi pos., secondo lei come dovremmo fare questo confronto?, qualè il criterio di accettabilità?
Ci hanno inoltre detto di estendere questo confronto anche per la ripetibilità (r).
Può consigliarci come procedere? Grazie
Buongiorno. Se ho capito bene parliamo di microbiologia degli alimenti (per le acque si potrebbero fare ragionamenti diversi, forse più semplici). La richiesta è tipica e viene fatta da chi si limita a ripetere quanto trova scritto sulla lista di riscontro che gli viene richiesto di compilare, evitando però di mettere in moto il ragionamento (e talvolta non capendo nemmeno quanto scritto nella lista stessa). Innanzitutto il metodo ISO 6888 (sia prima che seconda parte) NON RIPORTA alcun dato di incertezza. Esso riporta, al pari di quasi tutti i metodi simili, dati di ripetibilità e riproducibilità. E’ oltremodo chiaro (vedere punto 11.3 di ciascuna delle due parti del metodo) che di riproducibilità si parla quando si confrontano le prestazioni di diversi laboratori. I dati delle tabelle C delle due parti del metodo sono riferiti a prove interlaboratorio. Assurdo quindi pensare di applicare questi criteri in un singolo laboatorio. Per quanto riguarda la ripetibilità, invece, le due parti del metodo indicano chiaramente un limiite r, sia come differenza che come rapporto. Il laboratorio deve valutare che la differenza tra due ripetizioni (in condizioni di ripetibilità) non superi i valori riportati per più del 5% delle prove eseguite (sì, talvolta si può superare il limite di ripetibilità, e questo potrebbe avvenire anche nella prova in doppio che si esegue in visita ispettiva: ne terrnanno conto o faranno finta di non aver letto?). Il laboratorio deve poi (dovrebbe? boh, ancora non hanno deciso, lassù…) svolgere le attività previste da ISO 16140-3 per verificare che il proprio SR intralaboratorio sia compatibile con i dati pubblicati, secondo i criteri descritti dalla stessa ISO 16140-3 (dei quali abbiamo trattato al corso). Il confronto r / U non ha invece alcun senso in microbiologia: la ripetibilità (per la quale proprio alla luce di quanto indicato da ISO 16140-3 viene meno la necessità di calcolo interno, ci sarebbe quindi da discuttere su questa “tradizione” di continuare a richiederla) viene ottenuta normalmente con una sperimentazione su un singolo campione, con 10 ripetizioni, ovviamente a un singolo livello, mentre l’incertezza viene determinata con le procedure descritte da ISO 19036. Un classico confronto “mele con patate”. A fronte di una riserva che feci qualche tempo fa centrata su questo punto, d’accordo con l’ispettore, per “vedere l’effetto che fa”, la risposta fu più o meno “fate comunqnue il confronto e poi, se la condizione 2U > r non è soddisfatta, spiegate che è perché il confronto non ha senso”. Un punto di vista interessantissimo, sarebbe piaciuto molto a Franz Kafka che magari ci avrebbe scritto un libro. Per completezza devo dire che il tutto risale a prima della ISO 16140-3, magari oggi risponderebbero diversamente…
La ringrazio, vediamo di rivedere per bene la ISO 16140-3
Buongiorno.
Il mio laboratorio utilizza il sistema Colilert-18/Quantitray per la prova accreditata “Conta di coliformi totali e Escherichia coli”, metodo UNI EN ISO 9308-2:2014 nelle matrici acque destinate al consumo umano. La norma UNI EN ISO 9308-2:2014 riporta il sistema Colilert-18/Quantitray, marchio registrato Idexx.
Di recente ci è stato presentato un prodotto equivalente, Colikat Rapid, la cui composizione del reagente è uguale a quella riportata nell’Annex C della ISO 9308-2. La scheda prodotto di questo Colikat riporta la dicitura “compliance with EN ISO 9308-2”. Sul sito è disponibile uno studio di equivalenza tra i due prodotti, Colikat versus Colilert, in accordo alla ISO 17994. Questo è sufficiente per dire che Colikat è norma UNI EN ISO 9308-2:2014? il link del prodotto con tutte le info è il seguente: https://www.colikat.com/
Il nostro laboratorio, accreditato per la suddetta prova, può usare questo prodotto in alternativa al Colilert-18/Quantitray, considerando che il metodo UNI EN ISO 9308-2 parla esclusivamente di Colilert-18/Quantitray?
Rimango in attesa di un cortese riscontro.
Grazie mille.
Buongiorno dottoressa
Conosco il prodotto, so che si sta diffondendo abbastanza e che alcuni laboratori lo utilizzano.
Leggiamo attentamente la ISO 9308-2:2012. Nell’introdizione è riportato che “The ISO draws attention to the fact that it is claimed that compliance with this document MAY involve the use of patents concerning Colilert-18 and Quanti-Tray…”.
“MAY”, non “shall”.
Ancora: “The holder of this patent right has assured the ISO that he/she is willing to negotiate licences either free of charge or under reasonable and non-discriminatory terms and conditins with applicants throughout the world…”.
Chiaro quindi che l’intenzione dell’ISO non era quella di favorire il detentore del brevetto, come anche esplicitato in parecchie delle note al documento.
Interessante anche quanto riportato nell’appendice B, punto B.2.1.1, laddove si cita il possibile uso di altri sistemi di diluizione seriale MPN, purché conformi alle specifiche. In definitiva l’importante è che il numero e il volume dei pozzetti del prodotto alternativo siano proprio quelli indicati in dettaglio proprio in questa appendice.
Penso quindi che, se non si ragiona da burocrati ottusi ma da tecnici competenti nella materia, si possa ritenere del tutto conforme l’uso di un prodotto “alternativo” al Colilert-19 o al Quanti-Tray, a quest’ultimi assimilabile, purchè sia dimostrato (come nel vostro caso) che esso è equivalente a quello “standard”.
Circolano però personaggi che non si fidano nemmeno delle certificazioni dei lotti di prodotto fornite da Idexx… me li immagino alle prese con un caso come questo e con la loro atavica paura di non compiacere chi ce li manda, mista alla impellente necessità di sembrare più “bravi” e originali di chiunque nell’arte della formulazione dei rilievi…
Gent.mo dott. Tarditi,
ho seguito il corso su validazione e verifica ed avrei una domanda da
fare sulla verifica del metodo legionella 11731.
In fase di implementazione del metodo ho verificato le nostre
prestazioni confrontandole con i dati di prestazione forniti dal
metodo
tabella H.1 della norma , in cui la ripetibilità del metodo viene
indicata come percentuale CV%, quindi poichè per stabilire il limite
di ripetibilità uso il modulo 30 arpat, nel quale calcolo oltre al
limite di ripetibilità (r), anche il CV% di r, ho confrontato il CV%
calcolato con quello fornito dalla norma pensando che bastasse. Invece
l’ispettore accredia vuole che confronti secondo la seguente A≤ Sr/σ
≥B, solo perchè nella mia procedura è scritto che lo faccio, ma io
questo lo faccio quando il metodo mi indica i suoi dati di
ripetibilità.
Faccio bene a sostenere che il confronto tra i due CV e sufficiente
oltre al fatto che nei circuiti ho sempre ottenuto uno z score
bassissimo?
Buongiorno dottoressa
Non so chi sia l’ispettore ma vedo che egli ha poca fantasia e poca flessibilità. Se la procedura non prevede un caso come questo, si cambia la procedura. L’approccio A ≤ Sr/σ ≤ B va bene per la chimica. La microbiologia (e il complesso delle norme ad essa inerenti) sta prendendo da anni una strada diversa, decisamente più sovrapponibile a quella da Lei adottata.
Fa benissimo a seguire la strada da Lei scelta e a sostenere (anche vigorosamente) le Sue scelte.
Se volesse fare qualcosa in più, consiglio di verificare la sovradispersione, come indicato nel corso e come fattibile col foglio di calcolo fornito.
Buongiorno dott. Tarditi,
ho seguito con moltissimo interesse il suo corso FAD “Validazione e verifica prestazionale dei metodi nel laboratorio di microbiologia” Venerdì 22/9/22.
Premetto che il corso mi è piaciuto veramente tanto e mi ha dato la possibilità di focalizzare l’attenzione sui punti veramente importanti della norma ISO 16140-3 e sul fatto che è sempre importante ragionare e non assimilare concetti in maniera passiva come purtroppo spesso si è costretti a fare per mancanza di tempo.
Mi permetto di farle alcune domande perché so in partenza che mi darà risposte puntuali ma …comprensibili e calate nella realtà del laboratorio che cerca di attenersi scrupolosamente alla normativa ma non ha di certo risorse illimitate di soldi, tempo e personale.
Premetto che in sede di visita ispettiva Accredia ci hanno suggerito con calma di leggere la norma ISO 16140-3 dicendo che tanto avremmo avuto molto tempo per poterla applicare in quanto sarà pienamente in vigore dal 2028.
Mi sono pertanto approcciata all’analisi della norma “con calma” ma mi sembra di aver capito che sia come sempre in vigore dalla sua pubblicazione cioè da un anno e mezzo fa..
1. a questo punto il 2028 che deadline è?
2. Devo aggiornare MQ? E le procedure/istruzioni collegate alla validazione dei metodi? Devo aprirmi una NC perché non ho aggiornato nei tre mesi dalla pubblicazione?
3. Posso utilizzare lo schema di verifica riportato nell’ultima slide dell’incontro Accredia 05/11/2021 che le allego?
4. In laboratorio analizziamo solo alimenti di origine vegetale e le verifiche delle caratteristiche prestazionali dei metodi sono sempre state effettuate su questi prodotti. Facendo riferimento al file in allegato “macrocategorie alimenti” come distinguerebbe categorie, matrici e prodotti (item) indicati con confusione nella norma ISO 16140-3?
Ringraziandola anticipatamente, le porgo cordiali saluti
Buongiorno, complimenti per il corso.
Per la validazione del metodo di funghi nelle acque Rapporti ISTISAN 07/5 non ci sono norme di riferimento, ne tanto meno PT, l’unica via consigliataci dall’ispettore Accredia è stata l’utilizzo di ceppi a titolo noto. Secondo lei è l’unica via percorribile?
Purtroppo per i Funghi nelle acque non abbiamo trovato un metodo di riferimento ISO per questo motivo stiamo utilizzando l’ISTISAN; i funghi nelle acque ci vengono richiesti per le acque di dialisi e il cliente richiede che il parametro sia accreditato. Credo che la questione dell’ulizzo di ceppi a titolo noto fosse riferita all’assenza di PT, non alla validazione.
La ringrazio per i consigli.
uongiorno,
vorrei chiedere un’informazione se possibile. Siamo un laboratorio e
vorremo validare il metodo descritto dalla 18593 per quel che
riguarda il campionamento tramite piastre da contatto, quello per i
tamponi lo abbiamo già fatto. Il problema è che non sappiamo come
poter fare praticamente questa validazione, nel senso che mentre per i
tamponi è possibile intingerlo in un liquido contaminato, per le
piastre risulta essere più complicato. Avete qualche suggerimento a
riguardo? La ringrazio per la disponibilità e mi scuso per il disturbo
Buonasera Dottor Tarditi,
ho seguito il Corso Online e l’ho trovato molto esplicativo!!!
Il metodo in questione è la Ricerca Staphilococco aureo nelle matrice acque minerali, il quale è riportato su una Circolare del Ministero della salute che fa riferimento ai metodi alternativi a quelli proposti dal D:M 10 febbraio 2015; in questo caso il metodo deve essere validato???
Se si quali sono i parametri da determinare per i metodi qualitativi matrice acqua e quante prove è necessario eseguire per ogni parametro? Inoltre il metodo ufficiale prevede come prova di conferma la colorazione di Gram, ma se la prova di conferma di riferimento (es. agglutinazione al lattice) dovesse dimostrare un’efficienza di determinazione del batterio superiore potrebbe essere sostituita alla colorazione di Gram,???
Buon pomeriggio Dottor Tarditi,
volevo confrontarmi con lei riguardo la validazione del metodo alternativo riportato nella circolare. Secondo lei si potrebbe pensare di validarlo confrontandolo con il metodo di riferimento riportato nel DM applicando la misura della concordanza???
Nello specifico vorrei filtrare 5 aliquote del campione positivo e incubarle sul terreno di riferimento (es. Baird Parker) e altre 5 aliquote sul terreno del metodo in esame ( Baird parker + RPF). Procedere allo stesso modo per il campione negativo!!Infine calcolarci la concordanza!!!
Inoltre avrebbe senso anche valutare la robustezza del metodo che è di tipo qualitativo, considerando che le temperature di incubazione dei due metodi sono differenti???
Buongiorno,
abbiamo avuto campioni di acqua minerale in cui abbiamo riscontrato la presenza di Staphilococco a Luglio 2022.
Lo abbiamo anche confermato con le prove di conferma, oltretutto su due lotti differenti!!!
Buongiorno,
ho appena seguito il corso ISO 13843 e qualche domanda.
1) Metodo ISO 9308-1, conferma con Ossidasi. E’ considerata conferma interna?
Metodo ISO 7899-2 Enterococchi, l’impiego di azide esculina agar è considerato come conferma interna? Posso evitare la seconda conferma esterna?
2) In caso dovessi eseguire la seconda conferma “esterna”: dove trovo indicazioni specifiche sul tipo di conferma da effettuare? Devo rivolgermi ai miei fornitori?
3)Per il metodo della carica microbica ISO 6222, quali caratteristiche prestazionali devo verificare? Ripetibilità, incertezza di conta ed efficienza? E’ corretto?
4) Confronto tra Chi quadro tabulato e chi quadro ottenuto da noi, per essere conforme il nostro deve essere inferiore al tabulato?
Grazie in anticipo per le sue risposte. Buona giornata.
Buongiorno,
ho completato il corso sulla ISO 13843 per necessità di verificare i metodi applicati in laboratorio sulle acque ( CBT, coliformi ed E coli, enterococchi e legionella). Da quello che ho capito i metodi con conferma possono essere verificati secondo le indicazioni di questa norma non obbligatoria, mentre per la CBT c’è qualche riferimento normativo che può consigliarmi?
La ringrazio